¿QUÉ ES EL ÁTOMO?
La unidad más pequeña de un
elemento químico que mantiene su identidad o sus propiedades y que no es
posible dividir mediante procesos químicos.
A principios del siglo XX, se había pensado que los
átomos eran indivisibles, de ahí su nombre a-tomo- 'sin división'
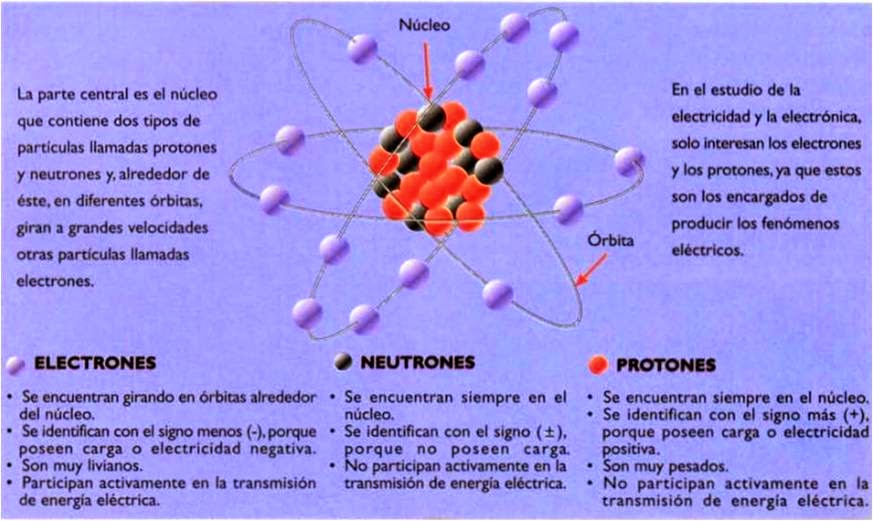
e- = abreviatura de electrones
p+ = abreviatura de protones
n = abreviatura de neutrones
p+ = abreviatura de protones
n = abreviatura de neutrones
•Los átomos de los diferentes
elementos tienen pesos diferentes.
•Los átomos permanecen
sin división, aun cuando se combinen en las reacciones químicas.
•Los átomos, al
combinarse para formar compuestos guardan relaciones simples.
•Los átomos de elementos
diferentes se pueden combinar en proporciones distintas y formar más de un
compuesto.
 Luego del descubrimiento
del electrón en 1897 por Joseph John Thomson, se
determinó que la materia se componía de dos partes, una negativa y una
positiva. La parte negativa estaba constituida por electrones, los cuales se
encontraban según este modelo inmersos en una masa de carga positiva a manera
de pasas en un pastel.
Luego del descubrimiento
del electrón en 1897 por Joseph John Thomson, se
determinó que la materia se componía de dos partes, una negativa y una
positiva. La parte negativa estaba constituida por electrones, los cuales se
encontraban según este modelo inmersos en una masa de carga positiva a manera
de pasas en un pastel.


 En 1911 Rutherford, lanzó la primera
teoría sobre la estructura del átomo, en ella decía que los electrones giraban
alrededor del núcleo como si fuera un sistema solar en miniatura. Esta teoría
se mantuvo hasta 1913
En 1911 Rutherford, lanzó la primera
teoría sobre la estructura del átomo, en ella decía que los electrones giraban
alrededor del núcleo como si fuera un sistema solar en miniatura. Esta teoría
se mantuvo hasta 1913
 1913, fecha en la cual Bohr, lanzó una nueva teoría
atómica, en ella decía que los electrones giran alrededor del núcleo en
órbitas. Esta teoría fue y es de las más importantes, llamada Teoría Atómica de
Bohr.
1913, fecha en la cual Bohr, lanzó una nueva teoría
atómica, en ella decía que los electrones giran alrededor del núcleo en
órbitas. Esta teoría fue y es de las más importantes, llamada Teoría Atómica de
Bohr.
«El átomo es un pequeño sistema solar con
un núcleo en el centro y electrones moviéndose alrededor del núcleo en órbitas
bien definidas». Las órbitas están cuantizadas (los e- pueden estar solo en ciertas
órbitas
•Cada órbita tiene una
energía asociada. La más externa es la de mayor energía.
•Los electrones no radian
energía (luz) mientras permanezcan en órbitas estables.
•Los electrones pueden
saltar de una a otra órbita. Si lo hace desde una de menor energía a una de
mayor energía absorbe un cuanto de energía (una cantidad) igual a la diferencia
de energía asociada a cada órbita. Si pasa de una de mayor a una de menor, pierde
energía en forma de radiación (luz).
•
• Bohr dió la explicación al
espectro de emisión del hidrógeno. Pero solo la luz de este elemento.
Proporciona una base para el carácter cuántico de la luz, el fotón es emitido cuando un
electrón cae de una órbita a otra, siendo un pulso de energía radiada.


No hay comentarios:
Publicar un comentario