En física, se denomina proceso termodinámico a la evolución de determinadas magnitudes (o propiedades) propiamente termodinámicas relativas a un determinado sistema termodinámico. Desde el punto de vista de la termodinámica, estas transformaciones deben transcurrir desde un estado de equilibrio inicial a otro final; es decir, que las magnitudes que sufren una variación al pasar de un estado a otro deben estar perfectamente definidas en dichos estados inicial y final. De esta forma los procesos termodinámicos pueden ser interpretados como el resultado de la interacción de un sistema con otro tras ser eliminada alguna ligadura entre ellos, de forma que finalmente los sistemas se encuentren en equilibrio (mecánico, térmico y/o material) entre sí.
TIPOS DE PROCESOS:
- Isotérmico: proceso a temperatura constante.
- Isobárico: proceso a presión constante.
- Isométrico o isocórico: proceso a volumen constante.
- Adiabático : a aquél en el cual el sistema no intercambia calor con su entorno.
- Diatérmico: Un proceso diatérmico quiere decir que deja pasar el calor fácilmente.
PROCESO ISOTÉRMICO
Se denomina proceso isotérmico o proceso isotermo al cambio reversible en un sistema termodinámico, siendo dicho cambio a temperatura constante en todo el sistema. La compresión o expansión de un gas ideal puede llevarse a cabo colocando el gas en contacto térmico con otro sistema de Capacidad calorífica muy grande y a la misma temperatura que el gas; este otro sistema se conoce como foco calórico. De esta manera, el calor se transfiere muy lentamente, permitiendo que el gas se expanda realizando trabajo. Como la energía interna de un gas ideal sólo depende de la temperatura y ésta permanece constante en la expansión isoterma, el calor tomado del foco es igual al trabajo realizado por el gas: Q = W.
Una curva isoterma es una línea que sobre un diagrama representa los valores sucesivos de las diversas variables de un sistema en un proceso isotermo. Las isotermas de un gas ideal en un diagrama P-V, llamado diagrama de Clapeyron, son hipérbolas equiláteras, cuya ecuación es P•V = constante.
PROCESO ISOTÉRMICO
Proceso isotérmico de un gas
Una expansión isotérmica es un proceso en el cual un gas se expande (o contrae), manteniendo la temperatura constante durante dicho proceso, es decir que T1 = T2 para los estados inicial (1) y final (2) del proceso isotérmico.
Recordemos que en un proceso isotérmico, la temperatura se mantiene constante.
La energía interna depende de la temperatura. Por lo tanto, si un gas ideal es sometido a un proceso isotérmico, la variación de energía interna es igual a cero.
Por lo tanto, la expresión de la 1ª Ley de la Termodinámica
De tal manera que en un proceso isotérmico el calor entregado al sistema es igual al trabajo realizado por el sistema hacia los alrededores.
Gráficamente el w se puede hallar calculando el área bajo la curva del diagrama P-V.
Por lo tanto, la expresión de la 1ª Ley de la Termodinámica
De tal manera que en un proceso isotérmico el calor entregado al sistema es igual al trabajo realizado por el sistema hacia los alrededores.
Gráficamente el w se puede hallar calculando el área bajo la curva del diagrama P-V.
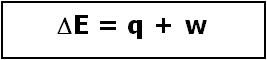
se convierte en: q = - w

Observen que el trabajo es el área bajo la curva (isoterma)
Proceso Isobárico
Recordemos que en un proceso isobárico, la presión permanece constante.
La mayoría de los cambios físicos y químicos ocurren a presión constante.
Por ejemplo, una reacción química, que se realiza en un sistema abierto, la presión es la presión atmosférica y ésta no varía durante el proceso.
Como hemos visto a presión constante:
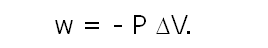
El calor involucrado en el proceso a P = cte. se denota como qP.
Aplicando la primera ley:
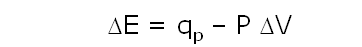
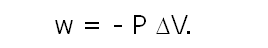
El calor involucrado en el proceso a P = cte. se denota como qP.
Aplicando la primera ley:
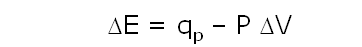
reordenando la expresión, podemos llegar a:
qP = (E2 + PV2) – (E1 + PV1)
Los químicos denominan Entalpía (H) al calor de un sistema a presión constante,
Siendo la Entalpía:
qP = (E2 + PV2) – (E1 + PV1)
Los químicos denominan Entalpía (H) al calor de un sistema a presión constante,
Siendo la Entalpía:
- Propiedad extensiva y
- Función de estado.
Entonces, en un proceso isobárico la expresión de la Primera Ley de la Termodinámica
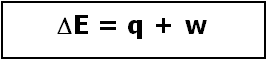
se puede expresar también como:

El proceso isobárico, en un diagrama PV:
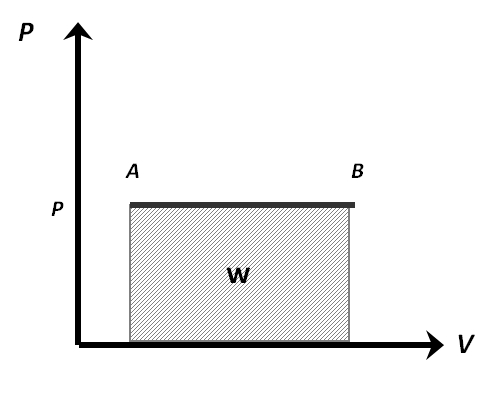
Se puede calcular el trabajo de manera gráfica, ya que él es área bajo la curva. Tengan en cuenta que, si se calcula de manera gráfica, las unidades del trabajo, estarían en atm-L. Normalmente se debe hacer un cambio de unidades a Joule o calorías.
PROCESO ISOCÓRICO
Un proceso isocórico, también llamado proceso isométrico o isovolumétrico es un proceso termodinámico en el cual el volumen permanece constante; ΔV = 0. Esto implica que el proceso no realiza trabajo presión-volumen, ya que éste se define como:ΔW = PΔV,
donde P es la presión (el trabajo es positivo, ya que es ejercido por el sistema).Aplicando la primera ley de la termodinámica, podemos deducir que Q, el cambio de la energía interna del sistema es:Q = ΔU
Para un proceso isocórico: es decir, todo el calor que transfiramos al sistema quedará a su energía interna, U. Si la cantidad de gas permanece constante, entonces el incremento de energía será proporcional al incremento de temperatura,Q = nCVΔTdonde CV es el calor específico molar a volumen constante.

En un diagrama P-V, un proceso isocórico aparece como una línea vertical.
Ejemplo:
¿Cuándo se incrementa la energía interna de 10 g de hielo que esta a cero grados centígrados cuando se transforma en agua manteniendo el volumen constante?
Como el proceso es isocórico, ya que no cambia el volumen, entonces w=0 y de acuerdo con la primera ley de la termodinámica la cantidad de calor ganado por el hielo es igual al cambio en su energía interna, es decir: Q= ΔU . Ahora bien, el calor de fusión del hielo es Q=mLf. en donde Lf=80cal/g.
sustituimos valores en la relacion anterior:
Q=(10g)(80cal/g)=800cal
por tanto, el cambio en la energía interna es:
ΔU=Q=800cal 4.19J/1cal=3352J

PROCESO ADIABÁTICO
El término adiabático hace referencia a elementos que impiden la transferencia de calor con el entorno. Una pared aislada se aproxima bastante a un límite adiabático. Otro ejemplo es la temperatura adiabática de llama, que es la temperatura que podría alcanzar una llama si no hubiera pérdida de calor hacia el entorno. En climatización los procesos de humectación (aporte de vapor de agua) son adiabáticos, puesto que no hay transferencia de calor, a pesar que se consiga variar la temperatura del aire y su humedad relativa.
El calentamiento y enfriamiento adiabático son procesos que comúnmente ocurren debido al cambio en la presión de un gas. Esto puede ser cuantificado usando la ley de los gases ideales

En termodinámica se designa como proceso adiabático a aquél en el cual el sistema
(generalmente, un fluido que realiza un trabajo) no intercambia calor con su entorno. Un
proceso adiabático que es además reversible se conoce como proceso isentrópico. El
extremo opuesto, en el que tiene lugar la máxima transferencia de calor, causando que
la temperatura permanezca constante, se denomina como proceso isotérmico.
EJEMPLO DE PROCESO ADIABÁTICO:
Fabricación de nieve artificial por la máquina: La máquina tiene una mezcla de aire comprimido y vapor de agua a 20 atm aproximadamente. Debido a la gran diferencia de presiones entre el tanque y la presión atmosférica, cuando la mezcla se rocía hacia la atmósfera se expande con tanta rapidez que no ocurre intercambio alguno de calor entre el sistema y sus alrededores.
Otro ejemplo es la temperatura adiabática de llama, que es la temperatura que podría alcanzar una llama si no hubiera pérdida de calor hacia el entorno.

PROCESO DIATÉRMICO
Una interacción térmica es cualquier otro tipo de intercambio de energía. En este caso la pared se denomina diatérmica. Diatérmico también puede entenderse por isotérmico , significa que no hay cambio de temperatura debido a una pared diatérmica que aísla el sistema del medio ambiente. En cuanto diatérmicos se refieren a que el sistema tiene un intercambio de energía con los alrededores, un ejemplo, nosotros, los seres humanos, somos sistemas diatérmicos, ya que estamos intercambiando energía con nuestro ambiente. Una pared diatérmica es aquella que permite la transferencia de energía térmica (calor) pero, sin que haya transferencia de masa. El opuesto es una pared adiabática que es la que impide la transferencia de energía en forma de calor. Cualquier superficie real es una superficie diatérmica, por ejemplo, un vaso, los muros de una casa, entre otros, todos en mayor o menor grado permiten la transferencia de calor.
EJEMPLOS DE PROCESOS DIATÉRMICOS:
-La fusión de los cubitos de hielo a temperatura ambiente
-El calentamiento de alimentos en una cazuela
-El enfriamiento de loas alimentos
-La subida de temperatura de un termómetro
-El enfriamiento de una bañera

hola
ResponderEliminarHOLA
ResponderEliminarholaa
ResponderEliminarGOOD JOB
ResponderEliminarMimamamepegaconunamesaayudaestonoesunmeme
ResponderEliminar